九价HPV疫苗为何一针难求?三期临床3年起,工厂投资至少十亿
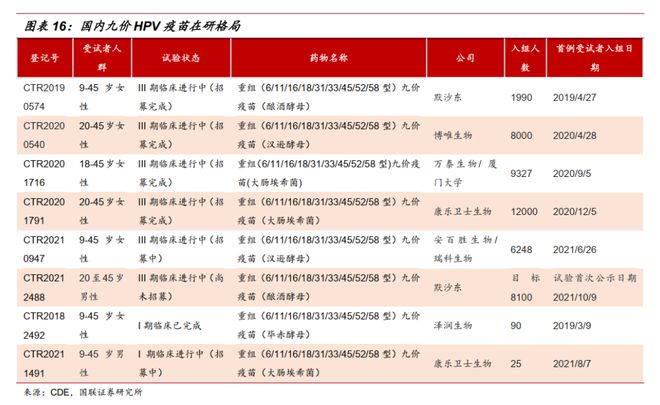
“扩龄也抢不到!”“不扩龄都约不上,扩了是不是更难约了?”“好消息,但供给得跟上啊!”“不是不打,是真的约不上!”近期,九价HPV(人乳头瘤病毒)疫苗的接种年龄从16岁至26岁扩展到9岁至45岁女性的消息引发关注。除了欣喜于这款预防宫颈癌的疫苗将造福更多女性群体之外,更多人发出了上述感慨,直指九价HPV疫苗“一针难求”的情况。HPV疫苗是一种可以预防宫颈癌的疫苗,因此又常被称为宫颈癌疫苗,也是目前世界上唯一可以预防癌症的疫苗。目前,国内共有五款HPV疫苗,包括三款进口疫苗和两款国产疫苗(均为二价),其中被认为能提供更多保护的九价苗,其生产制造商只有默沙东一家。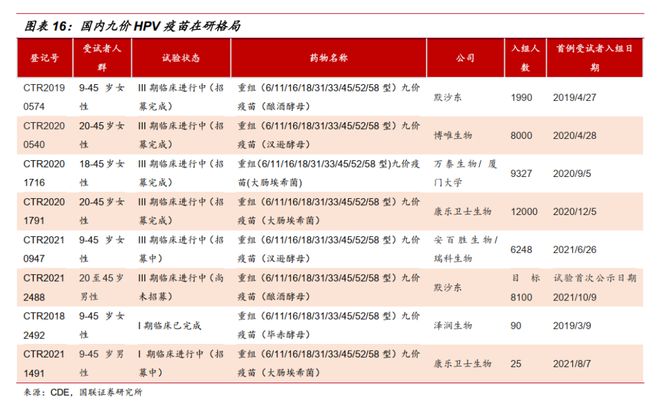 沃森生物、万泰生物、瑞科生物、康乐卫士、博唯生物等国内企业均在推进国产九价疫苗的研发,这些潜在产品也被认为是解决当前“一针难求”的新希望。但这一天并不会很快,据东亚前海证券研报,预计2025年及以后可能会有多款九价HPV疫苗陆续上市。九价HPV疫苗“一针难求”的现状摆在大众和所有企业面前,为什么无论是研发速度还是产能均无法提速?业内人士分析指出,这受到疾病特征、技术、资金、商业策略等多方面因素的影响。历经10多年才上市,HPV疫苗临床研究难在哪?虽然新冠疫情之下的新冠疫苗让人们看到了疫苗研发的加速度,但实际上,从疫苗研发历史来看,大部分疫苗从最初启动到最终上市需要消耗数年甚至十几年的时间。以两款已获批的国产二价HPV疫苗为例,前后均经历了十多年的时间。万泰生物(603392.SH)曾在2021年11月在投资者互动平台表示,二价HPV疫苗项目从2003年启动,2017年11月完成三期临床申报上市,2019年12月30日获批上市,2020年5月正式投入市场。按照这个时间线来计算,从启动到上市中间历经17年。今年3月底,沃森生物(300142.SZ)控股子公司泽润生物技术有限公司的二价HPV疫苗(毕赤酵母)终于获批上市。回看历史,这款自主研发的疫苗早在2011年6月就获得了药物临床试验批件,2020年6月申请新药上市许可获得《受理通知书》,前后历时11年的时间。
沃森生物、万泰生物、瑞科生物、康乐卫士、博唯生物等国内企业均在推进国产九价疫苗的研发,这些潜在产品也被认为是解决当前“一针难求”的新希望。但这一天并不会很快,据东亚前海证券研报,预计2025年及以后可能会有多款九价HPV疫苗陆续上市。九价HPV疫苗“一针难求”的现状摆在大众和所有企业面前,为什么无论是研发速度还是产能均无法提速?业内人士分析指出,这受到疾病特征、技术、资金、商业策略等多方面因素的影响。历经10多年才上市,HPV疫苗临床研究难在哪?虽然新冠疫情之下的新冠疫苗让人们看到了疫苗研发的加速度,但实际上,从疫苗研发历史来看,大部分疫苗从最初启动到最终上市需要消耗数年甚至十几年的时间。以两款已获批的国产二价HPV疫苗为例,前后均经历了十多年的时间。万泰生物(603392.SH)曾在2021年11月在投资者互动平台表示,二价HPV疫苗项目从2003年启动,2017年11月完成三期临床申报上市,2019年12月30日获批上市,2020年5月正式投入市场。按照这个时间线来计算,从启动到上市中间历经17年。今年3月底,沃森生物(300142.SZ)控股子公司泽润生物技术有限公司的二价HPV疫苗(毕赤酵母)终于获批上市。回看历史,这款自主研发的疫苗早在2011年6月就获得了药物临床试验批件,2020年6月申请新药上市许可获得《受理通知书》,前后历时11年的时间。
国家卫健委《宫颈癌诊疗指南》2022版
为什么HPV疫苗的研发需要如此之久?国内九价HPV疫苗研发企业之一瑞科生物的相关负责人向澎湃新闻记者介绍,这与HPV病毒本身感染特点、HPV疫苗临床研究终点的选择有关。上述负责人介绍,绝大多数宫颈癌与高危型人乳头瘤病毒(HPV)感染有着明确关联。从HPV感染发展到宫颈癌这个过程可能长达十年,需要依次经历一过性感染、持续感染、癌前病变等阶段。但绝大多数人感染后可能会通过自身免疫系统清除,不一定发展成为宫颈癌阶段。癌前病变根据严重的程度分为低级别和高级别。其中,高级别癌前病变被普遍认为具有较大可能发展为宫颈癌。因此,预防高级别癌前病变往往作为宫颈癌疫苗的首要临床研究终点。上述负责人进一步介绍,按照现有的监管要求,在研预防性HPV疫苗想要证明其保护效力,三期临床研究阶段必须获得预防高级别癌前病变的数据,这是目前此类疫苗临床研究终点的金标准。综合受试者数量和临床试验现场的HPV感染率情况,三期临床达到该终点至少需要3年至5年的时间。因此,HPV疫苗的临床研究整体持续时间相对较长。上述负责人还提到,由于九价疫苗相比二价、四价疫苗多出5至7个病毒样颗粒,导致其技术难度、高昂的三期临床整体费用(近5-7亿元)、大规模生产复杂性和相关制造成本(由于在VLP粒子聚合、维持VLP粒子稳定性及表达以及建立可靠的后续净化程序)等,这些因素与九价疫苗研发时间均密切相关。今年3月,康乐卫士在北交所招股书中披露的研究细节也提到HPV疫苗三期研究的时间跨度:公司九价HPV疫苗(女性适应证)三期临床试验后续需进行9次病例监测阶段随访,每次随访时间间隔为6个月。这个过程已经需要超过4年的时间。可以看到,康乐卫士的九价苗尽管已经在三期阶段,但招股书显示,该公司计划于2025年完成第6次病例监测随访后,进行三期临床试验期中分析,预计2026年底完成全部受试者随访并提交九价HPV疫苗上市申请,2027年九价HPV疫苗正式获批上市。
沃森生物关于九价HPV疫苗进入三期研究的公告
9月7日,沃森生物公告称,九价HPV疫苗启动Ⅲ期临床试验,此时距离该疫苗2018年1月获得临床批件已经过去四年多的时间。可以预见的是,进入三期临床试验以后,相关工作仍需要数年时间。那么,对于有了二价HPV疫苗研发经验的企业而言,是否意味着九价苗的研发更加容易?沃森生物曾在九价HPV疫苗获得临床试验批件的公告中提到,公司开展的二价HPV疫苗III期临床试验为九价HPV疫苗的临床研究奠定了坚实基础。对于上述问题,瑞科生物相关负责人向澎湃新闻记者表示,目前九价HPV疫苗保护效力的评价金标准仍以预防高级别癌前病变为主,相信这是从事九价疫苗研发的企业均要用临床数据回答共同的问题。九价苗的最小接种年龄是九岁,必然要求更小年龄的人群入组,这是否影响了相关疫苗的研究进展?上述负责人认为,该因素的影响并没有那么大。虽然因伦理要求,限制了临床研究无法直接通过病理学检查证实九价苗对未成年女性的有效性,但公司会首先在成年女性群体证实其九价疫苗的保护效力,而后通过免疫原性非劣效的桥接试验,利用血液的中和抗体水平判断疫苗效果;另一方面,经过近几年各个层面的宣教工作,人们对HPV疫苗的接受度也越来越高。一针难求,为什么HPV疫苗提高产能难?2018年,九价HPV疫苗在内地上市,在此之前,不少内地居民到香港接种该疫苗。当时就曾出现暂停供应、供不应求等情况。“经过长达五年较为稳定的市场需求发展, 2018年全球HPV疫苗的需求迎来重大拐点,全年较2017年增长一倍有余,并仍在持续攀升。”2020年8月,默沙东方面曾向澎湃新闻表示,对于需求激增,基于HPV疫苗生产的复杂性、长达四年的生产周期、不可或缺的严格质量管控,以及重大基础设施投入等因素,无法如愿迅速增加供应。对于HPV疫苗的产能,瑞科生物此前披露的数据显示,一期最高可实现HPV九价疫苗年产1000万剂。按照三针的接种剂次来计算,这些产能仅可满足300多万人的接种。“一针难求”的大背景下,为什么不尽可能提高产能?瑞科生物相关负责人在采访中介绍,由于我国《疫苗管理法》等现行疫苗管理条例规定,中国境内使用的疫苗不可以外包代工生产,因此需要每家企业自建疫苗商业化生产基地。由于九价苗生产工艺复杂、质量管理要求高,符合中国和海外监管GMP要求的疫苗工厂至少需要10亿元,而且从决定建厂到首批疫苗进入市场,至少也需要四至五年的时间。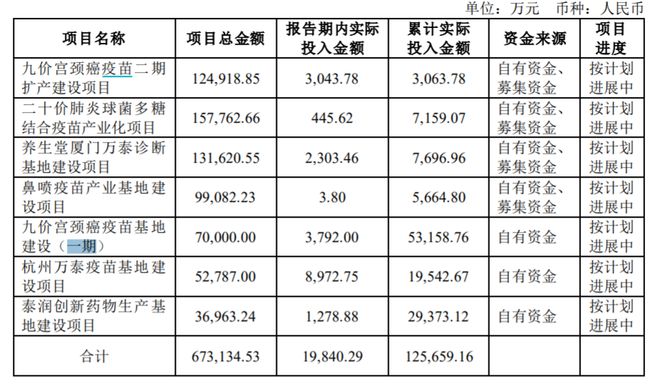
来源:万泰生物半年报
同样在推进九价苗的万泰生物在半年报中披露,万泰生物总投资7亿元的九价宫颈癌疫苗基地建设(一期),累计实际投入资金5.3亿元;总投资12.49亿元的九价苗二期扩产建设项目,累计实际投入资金3043.78万元。默沙东在产能提升方面同样投入巨大。2019年,默沙东投入超过10亿美元扩建已有的生产设施产能,并建造新的设施。今年4月,默沙东重申提升HPV疫苗可及性的承诺时提到,公司在生产方面进行了大量投资,近期扩建了位于美国弗吉尼亚州埃尔克顿的疫苗生产设施,在监管部门的审核批准下,完成建设面积12万平方英尺。技术层面,目前国内外各家企业在九价HPV疫苗采取了不同的表达系统,如默沙东用的是酿酒酵母,万泰生物、康乐卫士用的是大肠埃希菌,瑞科生物用的是汉逊酵母。上述负责人指出,不同的表达系统,后期在做工艺放大时,面临的难度也不同,这也会影响产能的释放。“无论是工艺技术,还是资金投入,均是九价苗产能释放的重要影响因素。”上述负责人提到,对于企业来说,在进行产能设计时,不仅要考虑市场需求,也需要综合自身的资金、技术实力、产业化团队等情况。另一位业内人士也向澎湃新闻记者提到,疫苗属于特殊的生物制品,需要严格的冷链体系,对于企业来说,产能越大,越要解决这些问题,如果跟不上很容易造成疫苗的浪费。尽管国产九价HPV疫苗的研发和产能建设仍需要一段时间,但业内普遍认为,国产HPV疫苗的入局,长期来看,是解决九价HPV疫苗“一针难求”问题的重要方式。此外,由于目前国内二价HPV疫苗逐渐放量,供应较为充足,也有医生呼吁,不必为了等高价HPV疫苗,而错过最佳的接种年龄。